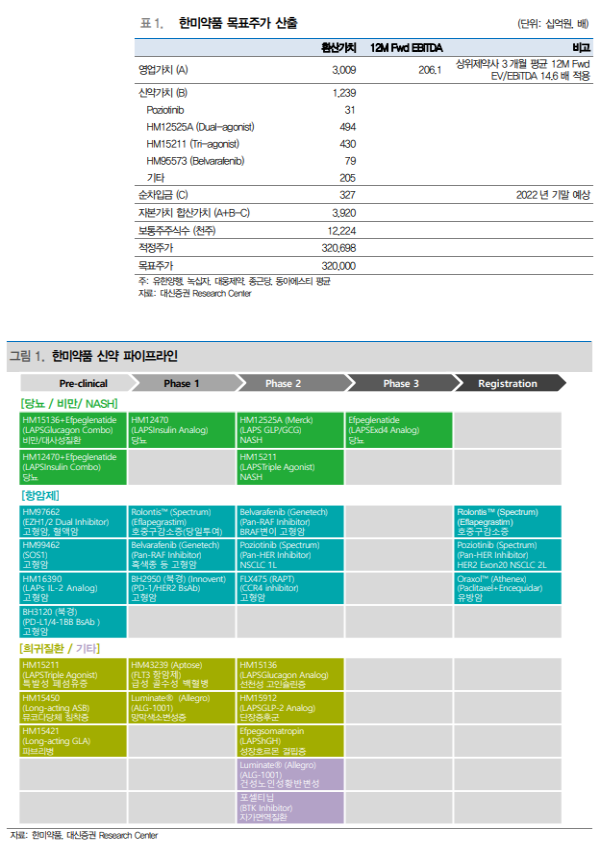
투자의견 매수, 목표주가 320,000원으로 하향 (-11.1%)
- 목표주가는 기술료수익을 제외한 12MF EBITDA에 국내 상위제약사 3개월 평 균 12MF EV/EBITDA 반영한 영업가치 및 신약가치를 SOTP 방식으로 산출.
- 목표주가는 1) 포지오티닙 허가 가능성 및 시기 조정에 따라 신약가치 305억 원으로 기존 대비 -80% 조정 2) 듀얼아고니스트 임상2상 결과발표 및 후속 임상 진입시기 반영에 따른 신약가치 조정 등에 따라 기존 대비 -11.1% 하향.
포지오티닙, FDA 자문위원회 부정적 의견 제시
- 9/22 FDA 항암제 자문위원회(ODAC)는 ‘포지오티닙’의 위험(risk) 대비 이익 (benefit)이 크지 않다는 결론을 내리며 자문위원 13명 중 9명이 신속허가 반대 의견 제시.
- 주요 내용은 1) 현존하는 치료법 대비 낮은 반응률 및 짧은 반응지속기간 (ORR 28%, mDOR 5.1개월) 2) 임상 참여 환자의 57%에서 용량 조절, 85%에 서 3-4등급 이상반응 나타나는 등 안전성 우려 3) 용량 최적화에 대한 데이터 불충분 4) 후속 임상 진행 지연 등을 포함.
- 경쟁약물 ‘엔허투’는 지난 8월 HER2 변이 비소세포폐암 적응증으로 FDA 신속 허가 획득. 허가에 기반이 되었던 임상2상(DESTINY-Lung02)에서 ORR 58%, mDOR 8.7개월 달성한 바 있음.
- FDA는 자문위원회 의견을 참고해 11/24 포지오티닙의 최종 허가 여부를 결정 예정.
신약 R&D 모멘텀 고려 시 주가 하락 과도하다는 판단
- 포지오티닙 신속허가에 대한 반대 의견 비중이 높은 만큼 후속 임상을 통해 효능 및 안전성에 대한 추가 데이터 확보 필요할 것으로 예상. 다만, 포지오티닙 은 경구제로 기존 치료요법인 주사제 대비 투약 편의성이 높고, 미충족 수요가 높은 환자들에게 추가 치료 옵션이 될 수 있기에 신약가치 반영은 유지.
- 연내 듀얼 아고니스트(HM12525A) NAFLD 임상2상 종료 예상. 23년 상반기 주요 결과발표 예상에 따라 후속 NASH 임상 진입은 23년 하반기로 전망.
- 포지오티닙 신약가치 비중 높았던 점 감안 시 주가 하락 과도했으며 견고한 실 적 성장세 및 23년 R&D 모멘텀 고려 시 저가 매수 기회로 판단.
 |
 |
<자료제공:대신증권>
박병우 기자 bwpark0918@pharmstock.co.kr
<저작권자 © 팜스탁, 무단 전재 및 재배포 금지>

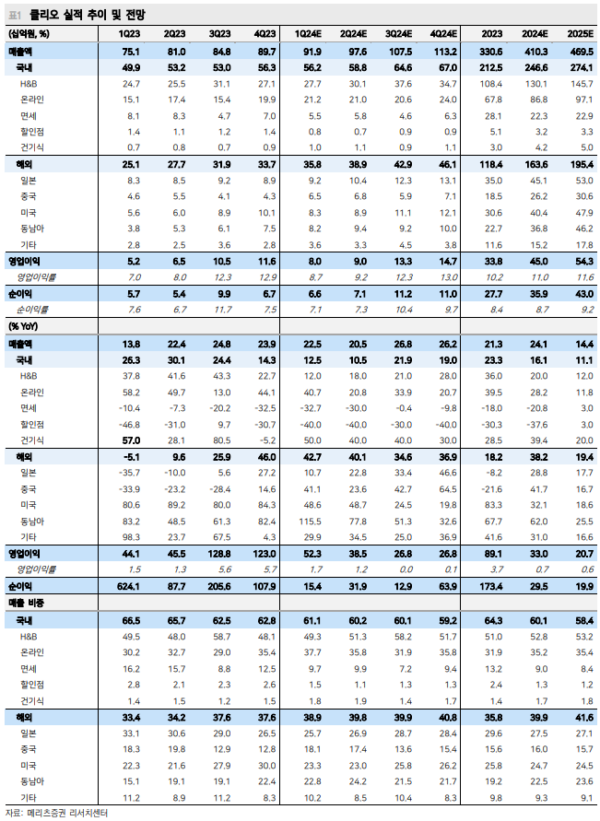 클리오, 일본 직접 한다
클리오, 일본 직접 한다




