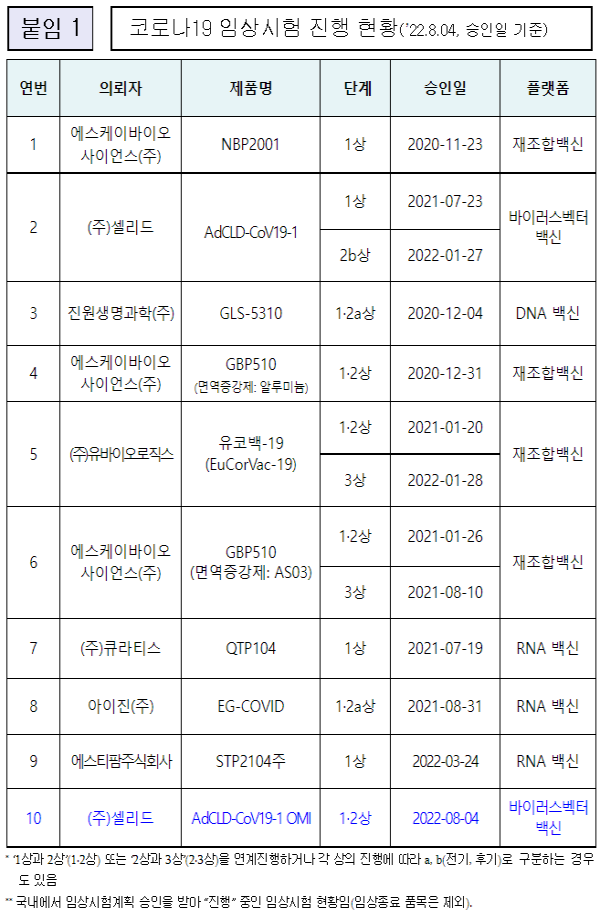
국내에서 개발되고 있는 코로나19 백신중 식품의약품으로부터 승인받은 품목은 모두 10개인 것으로 파악되고 있다.
10개의 코로나19 백신중 임상 3상은 유바이오로직스의 유코백-19 (EuCorVac-19), SK바이오사이언스의 GBP510(면역증강제: AS03)이다.
특히 식약처는 지난 6월 29일 SK바이오사이언스가 개발해 제조판매품목 허가를 신청한 코로나19 백신 GBP510(스카이코비원멀티주)에 대해 임상시험 최종 결과보고서를 제출하는 조건으로 지난 품목허가를 결정했다.
또한 식품의약품안전처(처장 오유경)는 ㈜셀리드사(社)가 신청한 국내 개발 코로나19 오미크론 백신 ‘AdCLD-CoV19-1 OMI’의 1·2상 임상시험계획을 8월 4일 승인했다.
‘AdCLD-CoV19-1 OMI’는 코로나19 오미크론 변이 바이러스의 ‘표면항원 유전자’를 아데노바이러스 주형에 넣어 제조한 ‘바이러스벡터 백신’이며, 1·2상 임상에서는 안전성과 면역원성을 평가한다.
임상시험의 투여방법은 허가 백신 접종을 완료한 사람 또는 코로나19 확진 후 격리 해제된 사람에게 추가접종 형태로 1회 투여이다.
식약처는 제출자료에 대한 면밀한 심사와 전문가 자문 등을 거쳐 임상시험의 안전성과 임상시험 설계의 적절성을 검토했다.
또한, 회사가 제출한 비임상시험 자료에서 마우스와 원숭이에게 백신을 접종한 후 오미크론 항원에 대한 중화항체가 생성된 것을 확인하는 등 임상시험 진입이 가능하다고 판단했다.
식약처는 앞으로도 안전하고 효과 있는 코로나19 백신·치료제가 신속히 개발될 수 있도록 지원해 국민들이 적정한 치료 기회를 보장받을 수 있도록 최선을 다할 계획이다.
 |
김사랑 기자 kimsarang0420
<저작권자 © 팜스탁, 무단 전재 및 재배포 금지>

 씨엔알리서치-로피바이오, FDA 아일리아 임상 3상 IND 승인
씨엔알리서치-로피바이오, FDA 아일리아 임상 3상 IND 승인