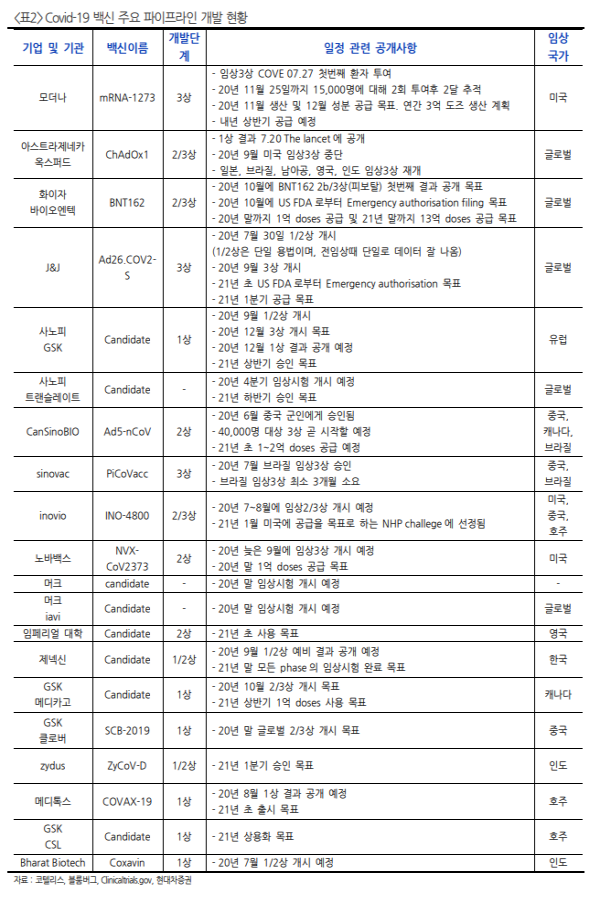
J&J 백신 임상3상 중단, 그러나 곧 재개될 것을 기대
- J&J 백신 임상3상은 임상 지원자의 원인을 알 수 없는 증상으로 인해 중단됨. 독립적인 위원회가 조사 중에 있으며, 원인 약물이 백신인지 위약인지 아직 알지 못하는 상태.
다만 J&J CFO 월크는 임상 중단이 단 며칠에 그칠 것이라고 언급하였으며, 개시가 된다면 2~3개월 내 임상 지원자에 대한 등록(6만명)을 마칠 것으로 기대함. 2021년 초에 백신을 배포할 수 있길 바라고 있으며 내년 말까지 10억회 이상의 투 약분을 생산하는 것을 목표.
- 아스트라제네카 백신 임상3상은 지난 9월9일 중단된 이후, 미국에서는 아직 재개되지 못함. 지연되는 명확한 원인을 알기는 어렵지만 1)참가자가 영국에 있음 2)유럽 EMA와 미국 FDA의 데이터 저장방식 차이 3)FDA의 세밀한 조사(7월 이상반응까지 조사) 등이 원인으로 지목되고 있음
- 유럽 EMA 동반심사가 개시된 아스트라제네카와 화이자 백신은 그대로 진행 중.
일라이릴리 항체치료제, 안전성 이슈로 임상 중단
- FDA에 긴급사용승인 신청이 된 항체치료제는 일라이릴리와 리제네론의 파이프라인. 그러나 10월 13일에 일라이릴리 항체치료제는 잠재적인 안전성 우려로 인해 임상3상 중단.
- 아스트라제네카 항체치료제는 미정부 산하 기관인 BARDA로부터 2개의 3상 및 10만도즈 공급 조건 으로 $486m을 지원받음. 해당 계약은 covid-19 예방목적으로써 항체치료제 개발 및 공급을 하기 위함.
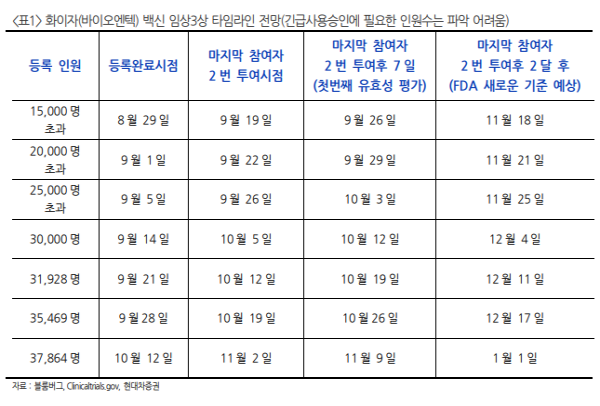
2020년 백신 승인 가능할까?
- Warp speed 수석고문 Moncef Slaoui는 추수감사절 전(11월말)까지 최소 1개의 covid-19 백신 긴급사 용승인 신청 전망. 최소 1개 이상의 백신이 11월말까지 FDA 긴급사용승인(EUA) 신청할 수 있을 것으 로 전망하며 올해 안에 고위험군에 대해 접종 시작 기대.
80-90%의 효능을 기대하며 이는 FDA의 최소 요구 효능인 50%보다 충분히 높은 수준(Warp speed : covid-19 백신의 빠른 공급을 위해 만들어진 미 국 정부 프로젝트) - 미국 국립 알레르기 전염병 연구소장 파우치는 Covid-19 백신이 2020년 말에 허가될 가능성을 전망 하며 연말까지 수백만 회분이 공급될 수 있을 것으로 판단함.
다만 트럼프 대통령이 올해 안에 미국이 1 억 회분의 백신을 확보할 수 있다고 한 것에 대해서는 부정적인 입장을 보임. 현재 후기 임상을 진행하 고 있는 모든 백신이 허가될 경우 내년 4월즈음 일반적인 인구가 투여하는데 충분한 물량이 공급 가능 할 것으로 전망.
 |
 |
<자료제공:현대차증권>
박병우 기자 bwpark0918@pharmstock.co.kr
<저작권자 © 팜스탁, 무단 전재 및 재배포 금지>

 씨엔알리서치-로피바이오, FDA 아일리아 임상 3상 IND 승인
씨엔알리서치-로피바이오, FDA 아일리아 임상 3상 IND 승인