국내 제약바이오기업들의 코로나19치료제 개발이 활기를 띠고 있다. 국내 제약바이오기업들의 코로19치료제 개발은 백신·혈장치료제등 다양하게 개발되고 있다.
 |
특히 코로나19 치료제로 승인받은 제품들중 금년 또는 내년초에 가시적인 성과가 나타날 것으로 전망되고 있다.
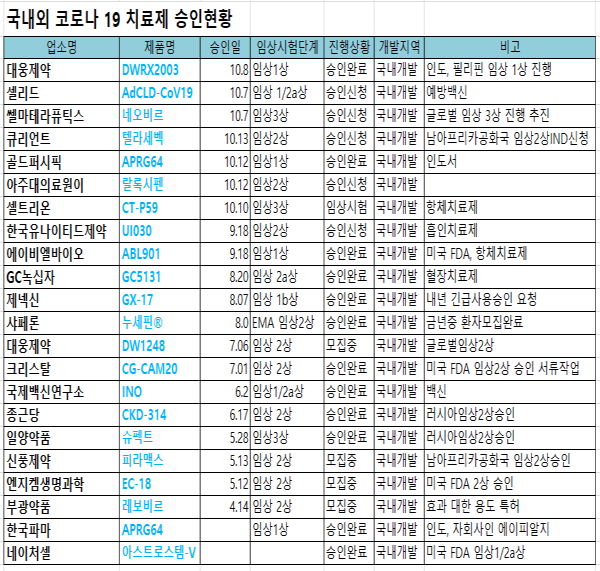
팜스탁이 집계한 국내 국외에서 코로나19 치료제 승인 또는 승인신청중인 품목은 모두 22개인 것으로 나타났다. 22품목중에서는 해외에서 승인받은 품목이 7개, 국내는 15개였다.
특히 국내 제약바이오기업들중 국내 임상뿐아니라 해외임상도 동시에 진행하고 있다는 점에서 주목을 받고 있다.
국내에서 임상 승인 받은 품목들중 가장 관심을 끌고 있는 제품은 셀트리온의 항체 치료제인 ‘CT-P59’이다. CT-P59는 최근 식품의약품안전처로부터 임상 3·3상 추진을 허가 승인 받고 예방 임상시험을 본격 개시한다. 셀트리온은 향후 글로벌 임상 결과와 코로나19 팬더믹 상황에 따라 조건부허가 신청도 검토 중이다.
GC녹십자는 정부 국책사업에 직접 참여해 혈장치료제 `GC5131`를 개발 중이며 현재 임상 2상을 진행하고 있다. 앞으로 총 60명을 대상으로 6개 의료기관을 통해 내년 2월까지 코로나19 혈장치료제에 대한 임상 2상을 진행할 계획이다.
대웅제약의 ‘DW1248정’(카모스타트)는 국내에서 임상 2상을 진행중에 있으며 멕시코 연구자 2상 임상에 최초로 돌입했고 'DWRX2003(니클로사마이드)'도 국내에서 임상 1상을 승인받았으며 인도와 필리핀에서도 임상 1상을 승인받았다.
엔지켐생명과학의 ‘EC-18’은 한국과 미국 FDA서 임상 2상 승인을 획득했으며 국내개발 신약으로 최초 미국 FDA 임상 2상이 성공할 것이라는 분석이다.
신풍제약의 ‘피라맥스’는 한국과 남아프리카공화국에서 임상 2상을 승인받았고 크리스탈 지노믹스의 ‘CG-CAM20’도 국내서 승인받은데 이어 미국 FDA임상 2상을 신청할 계획으로 있다.
종근당의 ‘나파벨탄’(CKD-314)도 국내에서 임상 2상을 승인받은데 이어 최근에 러시아에서도 임상 2상을 승인받았다.
쎌마테라퓨틱스의 ‘네오비르(Neovir-CoV)’는 최근 식품의약품안전처에 코로나19 치료제 개발을 위한 임상 3상시험을 신청했으며 지난 8월 글로벌 임상 3상 진행을 위해 유럽 최대 CRO(Contract Research Organization, 임상시험수탁기관) 업체인 'OPIS', 국내 업체인 '한국의약연구소(KMRI)'와 임상 진행 관련 협약을 체결한 바 있다.
일양약품의 ‘슈펙트’는 러시아 보건부로부터 임상 3상을 승인받았으며 최근 대상 의료기관을 기존 11개에서 29개로 확대했다.
한국유나이티드제약의 ‘UI030’은 임상 2상 시험계획서(IND)를 식품의약품안전처에 제출했으나 임상환자수의 문제로 인해 임상 2상 프로토콜을 상의하여 수정할 예정이다. 한국유나이티드제약은 기존 임상 2상 시험 프로토콜 환자수로 158명을 신청하였으나 코로나19 환자수가 감소, 국내에서 60명을 모집하고 필리핀 등 외국에서 임상 3상으로 350명 정도 모집해 동시 진행하는 것으로 프로토콜을 변경 신청할 예정이다.
김사랑 기자 kimsarang0420
<저작권자 © 팜스탁, 무단 전재 및 재배포 금지>

 클리오, 일본 직접 한다
클리오, 일본 직접 한다




