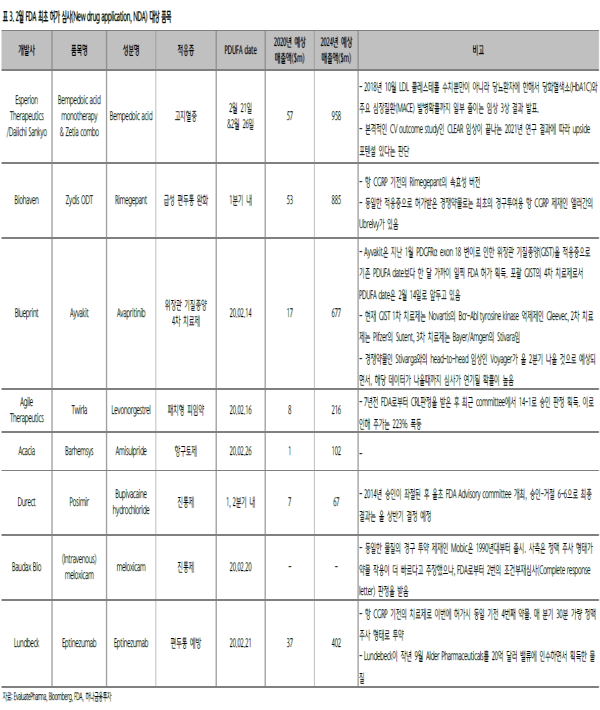
▶ 월간 FDA 심사 Checklist
2월에는 FDA 심사 재수, 삼수생들의 허가 발표가 대거 기다리고 있다.
FDA 심사는 초기 실패 이후에도 충분히 재도전이 가능한 만큼, 심사 결과가 조건부 재심사(Complete Response Letter) 판정이더라도 거절 사유가 품목의 펀더멘탈과 무관한것인지 면밀히 살펴볼 필요가 있다.
실례로, 아카시아파마(ACPH.LN)의 항구토제 신약 바헴시스(Barhemsys)의 경우, 과거 두 번의 FDA 심사에서 원료 물질 공급 계약의 부재를 이유로 조건부재심사(Complete Response Letter) 판정을 받은바 있다.
매번 주가는 큰 폭으로 하락했으나, 공급 계약 부재라는 펀더멘탈과 무관한 이슈라는 소식이 전해지며 주가는 항상 급락 이후 원점을 회복했다.
올 2월 26일이 세 번째 PDUFA date으로 FDA 시판 허가 삼수 끝의 결과는 어떨지 주목된다.
이외에도, 진통제인 포시미르(Posimir)와 정맥주사 제재 멜록시캄(Meloxicam), 패치형 피임약인 트월라(Twirla) 역시 한 두 차례 고배를 마신 후 재도전을 앞두고 있다.
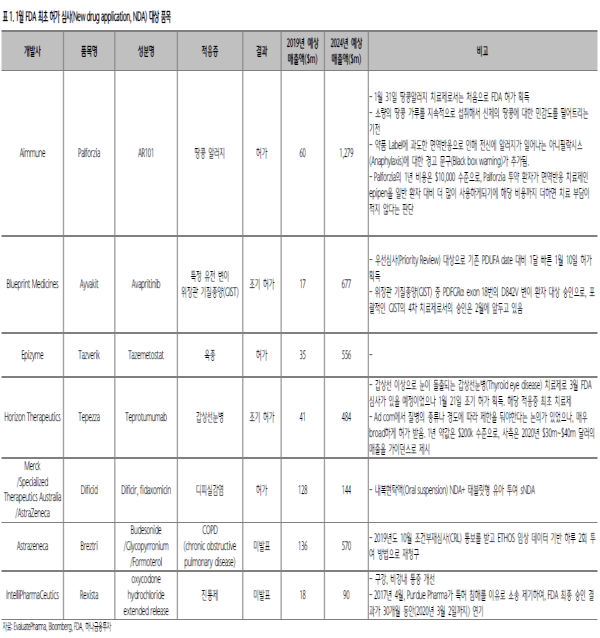
▶ 1월 Recap: 팔포지아(Palforzia), 오젬픽(Ozempic)
1월에는 최초의 땅콩 알러지 치료제인 에이뮨(Aimmune)의 팔포지아(Palforzia)가 FDA 허가를 받았다.
주요 부작용인 전신 두드러기 반응인 아나필락시스(Anaphylaxis)에 대한 경고문구가 부착되면서 팔포지아의 상업성에 대한 시장의 판단은 엇갈리고 있으나, 향후 블록버스터 약물 등극이 가능할 것으로 기대된다.
블루프린트(BPMC.US)의 위장관 기질종양(GIST)치료제 에이바킷(Ayvakit)과 호라이즌(HZNP.US)의 갑상선눈병 치료제 테페자(Tepezza)는 기존 PDUFA date 대비 한 달일찍 승인 결과를 받으면서, FDA가 혁신 신약에 대한 빠른 허가 기조를 유지하고 있음을 보여줬다.
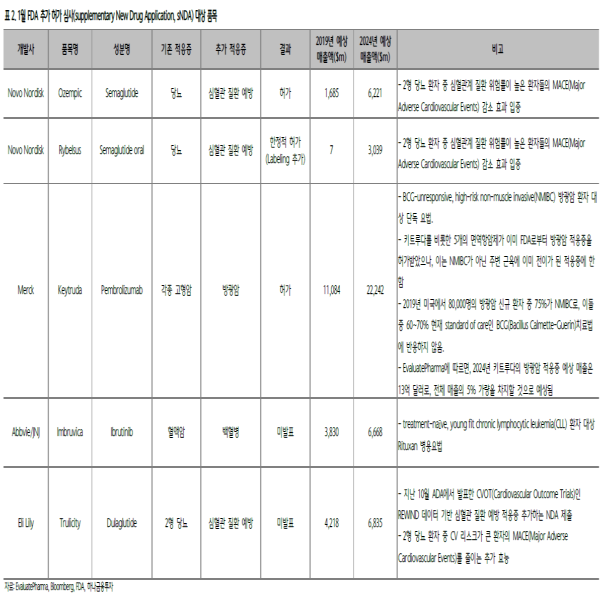
이 외에도, 노보노디스크(NOVOB.DC)의 1주 제형 GLP-1 제재 당뇨치료제 오젬픽(Ozempic)은 주요 심혈관계질환(MACE) 예방을 적응증으로 추가하며, 2024년에는 현재 시장 점유율 1위인 트룰리시티(Trulicity)에 준하는 매출을 올릴 것으로 기대된다.
2월 Preview: ETC-1002, 자이디스, ALD403, 에이바킷 에스페리온(ESPR.US)과 다이치산교(4568.JP)가 공동 개발중 인 고지혈증 치료제 ETC-1002는 단독 투여와 제티아(Zetia) 와의 혼합 투여 두 가지로 신약신청서를 제출, 각각 오는 2월 21일과 26일 심사 결과 발표를 앞두고 있다.
ETC-1002는 2018년 10월 콜레스테롤 수치뿐 아니라 당화혈색소 및 주요 심장질환 발병 확률까지 줄인 임상 3상 결과를 발표하면서, 2024년 10억 달러에 준하는 매출을 올릴 것으로 기대된다. 이 외에도 편두통 치료제인 바이오헤븐(BHVN.US)의 자이디스 (Zydis ODT)와 룬드벡(LUN.DC)의 ALD403 심사 결과 역시 이번 달 발표될 것으로 예상된다.
에이바킷(Ayvakit)은 지난달 특정 유전 변이를 동반한 암에 한정해서 조기 허가를 받은 바 있으며, 오는 14일에는 전체 위장관 기질종양으로 적응증을 확 대한 FDA 심사 결과 발표가 있을 예정이다.
 |
 |
 |
 |
<자료제공:하나금융투자>
박병우 기자 bwpark0918@pharmstock.co.kr
<저작권자 © 팜스탁, 무단 전재 및 재배포 금지>

 씨엔알리서치-로피바이오, FDA 아일리아 임상 3상 IND 승인
씨엔알리서치-로피바이오, FDA 아일리아 임상 3상 IND 승인



