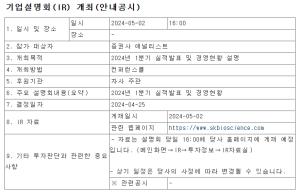
국내 방사성의약품 1위 기업인 듀켐바이오가 식약처로부터 도파체크주사(F-DOPA) 품목허가를 획득함에 따라 코스닥 이전 상장이 본격적으로 추진될 예정이다.
 |
코넥스기업인 듀켐바이오는 지난 6월 상장예비심사 청구서를 제출, 금년중에 코스닥시장 진출이 예정되었으나 식약처의 신규제품 판매 허가를 받은후에 심사해줄 것을 요청했기 때문이다.
듀켐바이오는 지난 6월 20일 거래소에 예비심사청구서를 제출, 거래소의 예비심사기간 45거래일의 규정이 적용될 경우 8월초에 심사 결과가 나왔어야 했다.
하지만 듀켐바이오는 식약처의 품목허가를 받은 상황에 있어 일정기간 심사기간 연장을 신청했다. 식약처에서 품목허가 승인을 받고 상장할 경우 기업가치가 높아지기 때문이다.
듀켐바이오 관계자는 상장 절차가 늦어진 것에 대해 “식약처 신규제품 판매승인을 앞두고 있어서 일정기간 심사기간 연장을 신청한 것”이라며 “좀 더 좋은 상황에서 평가를 받고 코스닥에 이전상장 하기 위함”이라고 설명한바 있다.
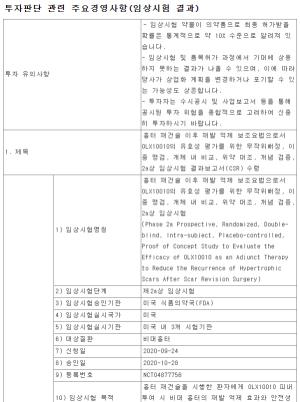
듀켐바이오는 도파체크주사(F-DOPA)에 대한 의약품 신규 품목허가를 식품의약품안전처로부터 지난 22일 획득했다고 공시했다.
품목허가와 관련하여 회사 관계자는 “도파체크주사는 세계 최초로 중성 주사액으로 개발에 성공한 방사성의약품으로 기존 산성 주사제 사용에 따른 위험성을 없애고, 의약품의 안정성, 편의성, 간편성을 높인제품이다”라고 말했다.
또 “기존의 암진단 방사성의약품(FDG)로는 진단이 어려웠던 뇌종양, 신경내분비종양, 갈색세포종 등의 진단을 가능하게 한 제품으로 종양의 악성도 예측 및 재발을 조기 발견할 수 있게 됐다"라며 "식약처 품목 허가 획득을 통해 듀켐바이오는 보유기술의 우수성을 입증하였으며, 제품의 안정성 및 유효성을 검증받음과 동시에 국내시장 제품 판매와 해외시장 수출에도 또한 기여할 것으로 기대한다”라고 말했다.
듀켐바이오가 식약처로부터 의약품 신규 품목허가를 획득함에 따라 코스닥이전상장이 본격 추진될 것으로 전망된다. 듀켐바이오가 코스닥상장 상장예비심사 청구 심사 연기를 요청한 사항이 사라졌기 때문이다.
한편 듀켐바이오는 2002년 건강기능식품 회사인 메디복스로 출발했으며 2007년 듀켐바이오로 사명을 변경하면서 방사성의약품 개발에 본격 뛰어들었다. 듀켐바이오는 암진단 FDG, 파킨슨병 진단 FP-CIT, 알츠하이머 치매 진단 뉴라첵 등 다양한 진단 및 치료용 방사성의약품 신약 파이프라인을 보유하고 있으며, 자체 특허기술을 적용해 생산판매 및 임상실험을 진행하고 있다.
올해부터는 본격적으로 뇌종양 진단을 위한 ‘도파체크’, 유방암 진단용 ‘FES’ 등으로 파이프라인을 확대하고 재발/전이성 전립선암 진단 및 향후 각종 암 진단 및 치료방사성 의약품 개발과 국내 사업화 및 수출에 전략을 집중할 계획이다.
김사랑 기자 kimsarang0420
<저작권자 © 팜스탁, 무단 전재 및 재배포 금지>

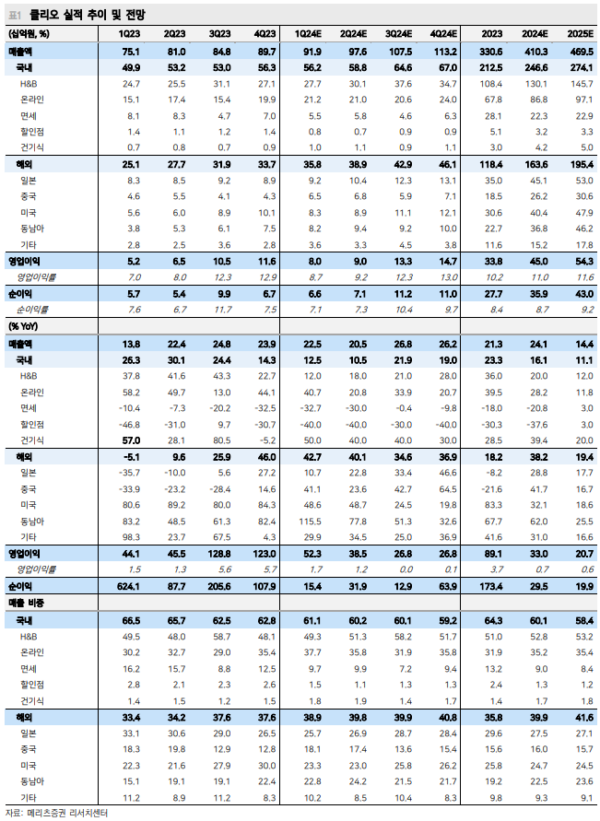 클리오, 일본 직접 한다
클리오, 일본 직접 한다